【國務院政策】讓百姓用得起更多救命藥放心藥
深化審評審批制度改革 鼓勵藥品醫療器械創新
讓百姓用得起更多救命藥放心藥
近日,中共中央辦公廳、國務院辦公廳印發《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(下稱《意見》)。這是繼2015年8月《國務院關于改革藥品醫療器械審評審批制度的意見》之后,又一個深化藥品醫療器械審評審批制度改革的重要文件,對我國醫藥產業創新發展具有里程碑意義。10月9日,國家食品藥品監督管理總局舉辦新聞發布會,對《意見》進行了解讀。
臨床急需藥品優先審批
國家食品藥品監督管理總局副局長吳湞表示,兩年來,相繼實施的藥品上市許可持有人制度試點、仿制藥質量和療效一致性評價、臨床試驗數據自查核查、醫療器械分類調整等改革舉措,解決了藥品注冊審批積壓嚴重的問題,一批創新和臨床急需藥品醫療器械優先獲準上市,為治療疾病提供了更多更好的選擇。
吳湞介紹說,近年來,我國醫藥企業新藥和創新醫療器械申報數量逐年增加。我國自主研發的利培酮緩釋微球、康柏西普眼用注射液等一批國產藥品在美歐發達國家申請注冊進入國際市場。
不過,我國藥品醫療器械研發和質量與國際先進水平仍然存在較大差距。統計數據顯示,2001年至2016年,發達國家批準上市的創新新藥共計433種,在我國上市的只有100余種。“近10年來,我國上市的一些典型的新藥時間平均要比歐美晚5年至7年,國外都已經用了六七年了,中國才上市,這是因為很多制度設計造成了新藥在中國上市慢半拍。”吳湞坦言,《意見》的發布就是要加快臨床急需藥品和醫療器械的上市審評速度,解決公眾用藥需求。
吳湞表示,只有創新才能研發出更多的質量高、療效優的新藥好藥,才能使更多的新藥好藥上市。在制度設計里,有些臨床急需的新藥將優先審批,從而降低研發成本,也有利于降低新藥上市價格,更好地實現藥品的可及性,“我們既要有新藥,還要有讓老百姓用得起的新藥”。
臨床試驗機構資格認定改為備案管理
一直以來,臨床研究資源短缺,是制約我國藥品醫療器械創新發展的重要原因。為此,《意見》提出,將臨床試驗機構資格認定改為備案管理,支持臨床試驗機構和人員開展臨床試驗。
“現行的臨床試驗機構的認定已經不能夠滿足創新發展的需求,在醫療機構和醫生緊缺的背景下,將臨床試驗機構資格認定改為備案制,可以減少中間環節,有助于提高臨床試驗研究者的積極性,有效地緩解醫療和科研的矛盾,保證臨床試驗質量。”國家食藥監總局藥品化妝品注冊管理司司長王立豐說。
數據顯示,在我國二級以上的醫療機構已經超過1萬家,三級以上的醫療機構有2000多家,但是現在能夠做藥物臨床試驗的機構通過認定的只有600多家,某種程度上成為醫藥創新的瓶頸。
對于改革后的臨床試驗機構監管,國家食藥監總局醫療器械注冊管理司司長王者雄表示,今后將出臺臨床試驗機構的備案條件和備案管理辦法,建立醫療器械臨床試驗機構和臨床試驗項目備案管理信息系統,加強臨床試驗機構和臨床試驗項目的監督檢查,對臨床試驗過程中弄虛作假、捏造臨床試驗數據的違法違規行為,依法予以嚴肅查處。
此外,《意見》還鼓勵社會力量投資設立臨床試驗機構等措施,切實拓展臨床試驗機構的數量,這也將提高臨床試驗研究者的積極性,有效緩解醫療和科研的矛盾。
組合拳保護藥品專利
《意見》提出,為保護專利權人合法權益,降低仿制藥專利侵權風險,鼓勵仿制藥發展,要探索建立藥品審評審批與藥品專利鏈接制度、開展藥品專利期補償的試點、完善和落實數據保護制度。“這三者合在一起,是知識產權保護的‘組合拳’,將有效保護專利權人的合法權益,激發創新活力。”吳湞表示,目前我國知識產權保護的力度仍有欠缺,這也是制約醫藥創新產業發展的一個重要原因。
吳湞表示,藥品知識產權保護的系列措施,完全符合建設創新型國家和促進醫藥產業創新發展的需求,對保護和激發我國正在蓬勃發展的民族醫藥創新活力,尤其是對我國特有的具有獨立自主知識產權的中藥領域將會發揮積極作用,全面提升我國醫藥產業的創新發展。
據介紹,《意見》的出臺及相關政策的實施,將極大地激發醫藥研發的活力,促進藥品醫療器械產業結構調整和技術創新,讓更多的新藥好藥和先進醫療器械上市,滿足公眾醫療需要,讓患者盡快用上救命藥、放心藥。(記者 吉蕾蕾)
【我要糾錯】 責任編輯:韓昊辰
提交
2024年斯凱孚創新峰會暨新產品發布會召開,以創新產品矩陣重構旋轉
禹衡光學亮相北京機床展,以創新助力行業發展新篇章
從SCIMC架構到HyperRing技術,機器人控制技術的革新
漢威科技用智慧化手段為燃氣廠站構筑安全防線
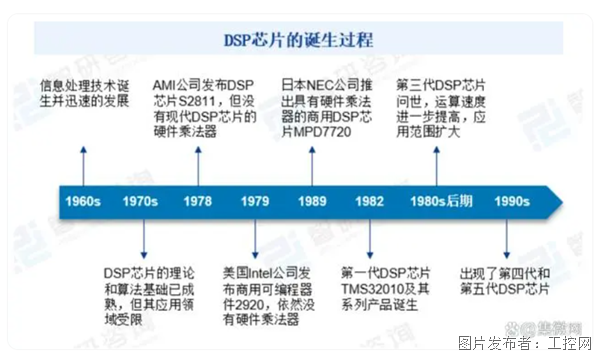
DSP應用市場的大蛋糕,國產廠商能吃下多少?








 投訴建議
投訴建議